УДК 615.37
Клиническое применение трансфер факторов на основе экстракта молозива
Мальцев Д.В.
Институт экспериментальной и клинической медицины НМУ имени А.А. Богомольца
Вступление
Общим термином «трансфер факторы» обозначают группу гетерогенных по составу иммунобиологических агентов, содержащих экстракт иммунных белков той или иной биологической среды организма донора. При введении такого продукта в организм реципиента осуществляется хорошо известный феномен переноса (трансфера) иммунитета, естественным образом реализующийся, например, у млекопитающих при грудном вскармливании потомства.
На данный момент разработано и внедрено в клиническую практику три вида препаратов трансфер факторов по происхождению – на основе диализата суспензии лейкоцитов крови, иммунного экстракта белков желтков куриных яиц и иммунного экстракта белков молозива. Имеются также комбинированные продукты, например, сочетающие в своем составе иммунные экстракты молозива и желтков куриных яиц. Трансфер факторы на основе экстракта иммунных белков молозива воспроизводят биологический феномен переноса иммунитета из организма матери в организм новорожденного, осуществляющийся при лактации на протяжении первых 3 суток после родов, когда биологический трансфер особенно интенсивен. При этом реализуются важные иммунозаместительные и иммуномодулирующие эффекты, позволяющие ребенку эффективно противостоять внешней микробной агрессии, сформировать нормальный биоценоз ротовой полости и желудочно-кишечного тракта и наладить процесс пищеварения.
На сегодняшний день имеются два вида подобных продуктов по происхождению – на основе человеческого и коровьего молозива, причем последние более распространены и характеризуются более обширной текущей доказательной базой. Также трансфер факторы на основе молозива могут быть нормальными и гипериммунными в зависимости от состояния адаптивного иммунитета доноров на момент забора биоматериала. На данный момент успешно апробировали как местное орофарингеальное, так и системное пероральное применение препаратов иммунного экстракта молозива.
Продукты на основе иммунных белков молозива на сегодняшний момент прошли многочисленные контролируемые клинические исследования по ряду направлений, которые будут детально рассмотрены в настоящем научном обзоре. По данным Rathe M. с соавт. к 2014 году в авторитетных рецензируемых периодических изданиях опубликовано, как минимум, результаты 51 контролируемого клинического испытания, в котором принимали участие указанные иммунобиологические агенты [30]. И хотя эти исследования очень отличаются по методологии и дизайну, что существенно затрудняет систематизацию их результатов, нельзя не согласиться, что трансфер факторы на основе экстракта молозива привлекали пристальное внимание клинических исследователей на протяжении последних десятилетий как перспективные и многообещающие средства иммунотерапии и профилактики при различной иммунозависимой патологии человека.
Состав и механизм воздействия
Трансфер фактор на основе иммунного экстракта молозива, как и аналогичные агенты другого происхождения, обладает известными иммунозаместительными и иммуномодулирующими свойствами, которые реализуются неразрывно друг от друга во время иммунотерапии.
Иммуномодулирующие эффекты при применении этих биологических продуктов отличаются от таковых у диализированного экстракта лейкоцитов крови и экстрактов иммунных белков желтков куриных яиц. Если в последних случаях усиливается функция Т-хелперов 1 типа и отмечается связанная с этим потенциация клеточного иммунитета, то при применении иммунного экстракта молозива активируются преимущественно Т-хелперы 2 типа, что приводит к повышению синтеза иммуноглобулинов, особенно – молекул секреторного IgA – важного компонента мукозального иммунитета [11]. Поэтому у трансфер факторов на основе экстракта молозива более выражен противомикробный эффект по отношению к некоторым бактериальным и вирусным возбудителям респираторных и кишечных инфекций, в достижении контроля над которыми критически важен именно местный мукозальный гуморальный иммунитет. Если говорить об модуляции врожденного иммунитета под влиянием трансфер фактора на основе иммунного экстракта молозива, то следует отметить возрастание в слюне и кишечном соке во время проводимой иммунотерапии содержания противомикробных белков лактоферрина [39] и альфа-дефензинов [31] с бактериостатическими и бактерицидными свойствами соответственно.
Также у таких биологических агентов сильнее проявляется иммунозаместительный эффект, чем у аналогов другого происхождения, так как в них содержится большое количество разнообразных гуморальных факторов иммунитета, секретирующихся из крови матери в молоко для дальнейшего трансфера в ротовую полость и желудочно-кишечный тракт ребенка для компенсации физиологической незрелости местного мукозального иммунитета.
Добавление к молозиву экстракта иммунных белков желтков куриных яиц в комбинированных продуктах усиливает указанные гуморальные иммунотропные эффекты дополнительным воздействием на клеточное звено иммунитета, особенно – на функциональную и пролиферативную активность естественных киллеров (СD3–CD16+CD56+ лимфоцитов), принимающих участие в противовирусном и противоопухолевом иммунитете организма человека [1].
Установлено, что в молозиве содержатся такие белки иммунной системы как лизоцим, лактоферрин, пептиды-антибиотики, цитокины, хемокины, растворимые рецепторы, белки системы комплемента, иммуноглобулины, которые опосредуют известные иммунозаместительные эффекты продуктов на основе экстракта иммунных белков молозива (рис. 1) [33].
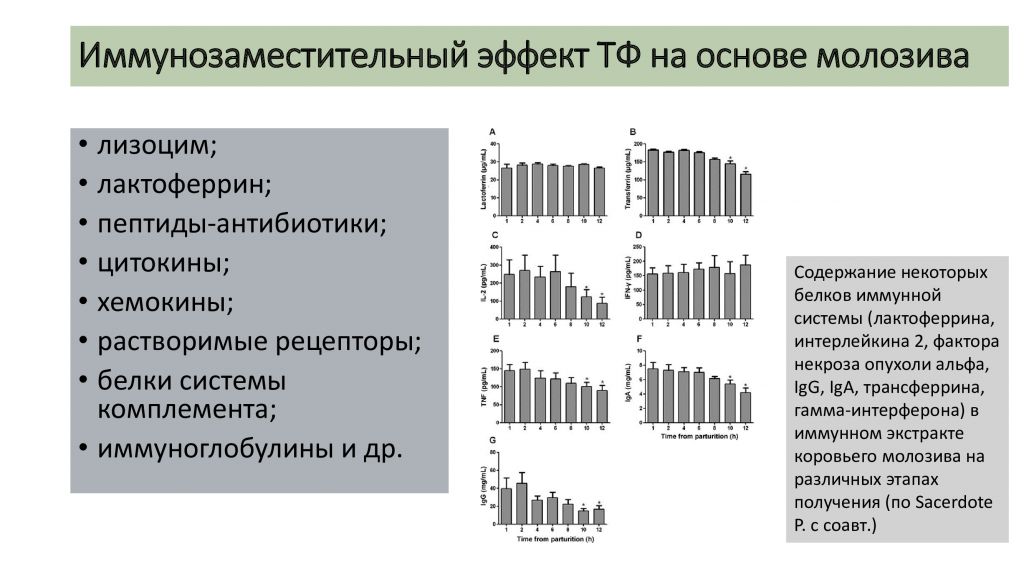
Рис. 1. Содержание некоторых белков иммунной системы (лактоферрина, интерлейкина 2, фактора некроза опухоли альфа, IgG, IgA, трансферрина, гамма-интерферона) в иммунном экстракте коровьего молозива на различных этапах получения (по Sacerdote P. с соавт.) [33]
В таблице продемонстрирован расширенный, но далеко не полный перечень белков, содержащихся в стандартизированном иммунном экстракте коровьего молозива, применяемого ныне в клинической практике, согласно с результатами специально спланированного исследования Zhang L. с соавт. [38].
Табл.
Содержание различных белков в стандартизированном иммунном экстракте коровьего молозива (one-sided t-test, α = 0,05) [38]
|
Protein IDs |
Protein name |
Gene name |
Biological function |
Subcellular location |
p value |
||
|
|
|
|
|
|
|
|
|
|
P01044 |
Kininogen-1 |
KNG1 |
Blood coagulation |
|
secreted |
|
0.000 |
|
P02672 |
Fibrinogen alpha chain |
FGA |
Blood coagulation |
|
secreted |
|
0.004 |
|
P02676 |
Fibrinogen beta chain |
FGB |
Blood coagulation |
|
secreted |
|
0.014 |
|
P06868 |
Plasminogen |
PLG |
Blood coagulation |
|
secreted |
|
0.009 |
|
P12799 |
Fibrinogen gamma-B chain |
FGG |
Blood coagulation |
|
secreted |
|
0.000 |
|
P17690 |
Beta-2-glycoprotein 1 |
APOH |
Blood coagulation |
|
secreted |
|
0.006 |
|
P02769 |
Serum albumin |
ALB |
Cell |
|
secreted |
|
0.013 |
|
Q2KIF2 |
Leucine-rich alpha-2-glycoprotein 1 |
LRG1 |
Cell |
|
secreted |
|
0.005 |
|
F1N076 |
|
CP |
Cell |
|
secreted |
|
0.003 |
|
F1MPP2 |
|
IGFBP7 |
Cell adhension |
|
secreted |
|
0.014 |
|
P31096 |
Osteopontin |
SPP1 |
Cell adhension |
|
secreted |
|
0.037 |
|
F1N514 |
|
CD5L |
Cell apootosis |
|
membrane |
|
0.002 |
|
P02702 |
Folate receptor alpha |
FOLR1 |
Cell death |
|
cell membrane |
|
0.042 |
|
O18738 |
Dystroglycan |
DAG1 |
Cell-Cytoskeleton |
|
secreted |
|
0.000 |
|
F1N4M7 |
|
CFI |
Enzyme |
|
membrane |
|
0.020 |
|
P05689 |
Cathepsin Z |
CTSZ |
Enzyme |
|
Lysosome |
|
0.001 |
|
Q29437 |
Primary amine oxidase, liver isozyme |
|
Enzyme |
|
secreted |
|
0.016 |
|
Q5E9B1 |
L-lactate dehydrogenase B chain |
LDHB |
Enzyme |
|
secreted |
|
0.013 |
|
F1MZ96 |
|
IGK |
Immunity |
|
secreted |
|
0.001 |
|
P00735 |
Prothrombin |
F2 |
Immunity |
|
secreted |
|
0.000 |
|
P01888 |
Beta-2-microglobulin |
B2M |
Immunity |
|
secreted |
|
0.000 |
|
P07589 |
Fibronectin |
FN1 |
Immunity |
|
secreted |
|
0.019 |
|
P12763 |
Alpha-2-HS-glycoprotein |
AHSG |
Immunity |
|
secreted |
|
0.021 |
|
P17697 |
Clusterin |
CLU |
Immunity |
|
secreted |
|
0.002 |
|
P19660 |
Cathelicidin-2 |
CATHL2 |
Immunity |
|
secreted |
|
0.011 |
|
P22226 |
Cathelicidin-1 |
CATHL1 |
Immunity |
|
secreted |
|
0.003 |
|
P28800 |
Alpha-2-antiplasmin |
SERPINF2 |
Immunity |
|
secreted |
|
0.002 |
|
P33046 |
Cathelicidin-4 |
CATHL4 |
Immunity |
|
secreted |
|
0.001 |
|
P54228 |
Cathelicidin-6 |
CATHL6 |
Immunity |
|
secreted |
|
0.005 |
|
P81187 |
Complement factor B |
CFB |
Immunity |
|
secreted |
|
0.002 |
|
P81265 |
Polymeric immunoglobulin receptor |
PIGR |
Immunity |
|
secreted |
|
0.001 |
|
Q29RQ1 |
Complement component C7 |
C7 |
Immunity |
|
secreted |
|
0.010 |
|
Q2KJF1 |
Alpha-1B-glycoprotein |
A1BG |
Immunity |
|
secreted |
|
0.000 |
|
Q2TBU0 |
Haptoglobin |
HP |
Immunity |
|
secreted |
|
0.023 |
|
Q2UVX4 |
Complement C3 |
C3 |
Immunity |
|
secreted |
|
0.001 |
|
Q32PA1 |
CD59 |
CD59 |
Immunity |
|
membrane |
|
0.017 |
|
Q3MHN2 |
Complement component C9 |
C9 |
Immunity |
|
secreted |
|
0.007 |
|
Q3SYR8 |
Immunoglobulin J chain |
IGJ |
Immunity |
|
secreted |
|
0.012 |
|
Q3SZR3 |
Alpha-1-acid glycoprotein |
ORM1 |
Immunity |
|
secreted |
|
0.002 |
|
Q3T052 |
Inter-alpha-trypsin inhibitor heavy chain H4 |
ITIH4 |
Immunity |
|
secreted |
|
0.012 |
|
Q3ZCH5 |
Zinc-alpha-2-glycoprotein |
AZGP1 |
Immunity |
|
secreted |
|
0.001 |
|
Q7SIH1 |
Alpha-2-macroglobulin |
A2M |
Immunity |
|
secreted |
|
0.004 |
|
Q95122 |
Monocyte differentiation antigen CD14 |
CD14 |
Immunity |
|
cell membrane |
|
0.001 |
|
Q0P569 |
Nucleobindin-1 |
NUCB1 |
Other |
|
Golgi apparatus |
|
0.002 |
|
Q3SX14 |
Gelsolin |
GSN |
Other |
|
Cytoplasm |
|
0.015 |
|
Q3ZBZ1 |
45 kDa calcium-binding protein |
SDF4 |
Other |
|
Golgi apparatus |
|
0.034 |
|
A2I7N1 |
Serpin A3–5 |
SERPINA3 |
Protease inhibitor |
|
cytoplasm |
|
0.002 |
|
|
|
|
|
|
|
|
|
|
F1MSZ6 |
Antithrombin-III |
SERPINC1 |
Protease inhibitor |
|
secreted |
|
0.001 |
|
P34955 |
Alpha-1-antiproteinase |
SERPINA1 |
Protease inhibitor |
|
secreted |
|
0.000 |
|
Q0VCM5 |
Inter-alpha-trypsin inhibitor heavy chain H1 |
ITIH1 |
Protease inhibitor |
|
secreted |
|
0.005 |
|
Q9TTE1 |
Serpin A3–1 |
SERPINA3–1 |
Protease inhibitor |
|
cytoplasm |
|
0.001 |
|
P60712 |
Actin, cytoplasmic 1 |
ACTB |
Protein synthesis |
|
Cytoplasm |
|
0.010 |
|
Q0VCX2 |
78 kDa glucose-regulated protein |
HSPA5 |
Protein synthesis |
|
ER |
|
0.025 |
|
A6QPK0 |
SCGB2A2 protein |
SCGB2A2 |
Signalling |
|
secreted |
|
0.030 |
|
O46375 |
Transthyretin |
TTR |
Transport |
|
secreted |
|
0.009 |
|
P15497 |
Apolipoprotein A-I |
APOA1 |
Transport |
|
secreted |
|
0.017 |
|
Q03247 |
Apolipoprotein E |
APOE |
Transport |
|
secreted |
|
0.008 |
|
Q0IIA2 |
Odorant-binding protein-like |
MGC151921 |
Transport |
|
secreted |
|
0.006 |
|
Q29443 |
Serotransferrin |
TF |
Transport |
|
secreted |
|
0.000 |
|
Q32KV6 |
Nucleotide exchange factor SIL1 |
SIL1 |
Transport |
|
ER |
|
0.032 |
|
Q3MHN5 |
Vitamin D-binding protein |
GC |
Transport |
|
secreted |
|
0.000 |
|
Q3SZV7 |
Hemopexin |
HPX |
Transport |
|
secreted |
|
0.000 |
|
F1MLW8 |
|
LOC100847119 |
unknown |
|
unknown |
|
0.000 |
|
G3N1R1 |
|
LOC100300716 |
unknown |
|
unknown |
|
0.000 |
Совместная и неразрывная реализация иммунозаместительных и иммуномодулирующих биологических эффектов трансфер факторов на основе иммунного экстракта молозива приводит к таким терапевтическим эффектам как усиление иммунорезистетности и связанной с этим противомикробной защиты организма, местное и системное противовоспалительное воздействие, а также – улучшение работы пищеварительной системы и формирование нормального микробиоценоза слизистых оболочек ротовой полости и дигестивного тракта.
Противовоспалительный эффект иммунного экстракта молозива, проявляющийся в снижении концентраций С-реактивного белка, провоспалительных цитокинов интерлейкинов-1бета и -6 [20] и повышении содержания противовоспалительного цитокина трансформирующего фактора роста бета в сыворотке крови и периферических биологических средах [24], важен в профилактике синдрома повышенной проницаемости кишечной стенки и связанной с этим эндотоксинемии при травмах, воздействии экстремальных факторов и тяжелых физических тренировках.
Как показали Deubzer H.E. с соавт., молозиво, полученное от женщин, иммунизированных во время беременности антипневмококковыми вакцинами, блокирует прикрепление пневмококка к эпителию верхних дыхательных путей in vitro и in vivo в организме новорожденного, препятствуя формированию входных ворот инфекции [7]. В соответствии с этим, Ojofeitimi E.O., Elegbe I.A. установили, что раннее начало кормления молозивом недоношенных новорожденных приводит к резкому снижению пролиферации условнопатогенных бактерий в их кишечнике, способствует формированию нормального биоценоза и обеспечивает поддержание адекватной проницаемости кишечной стенки [26].
Лечебное применение
Продукты на основе иммунного экстракта молозива были апробированы в качестве агентов иммунотерапии при некоторых кишечных и респираторных инфекциях, иммунодефицитных болезнях, дисбиозе кишечника, неспецифическом язвенном колите и сахарном диабете 2 типа у взрослых и детей.
Кишечные инфекции. Иммунобиологические агенты, содержащие иммунный экстракт молозива, уменьшают частоту и тяжесть инфекций желудочно-кишечного тракта у недоношенных новорожденных, снижают выраженность симптомов диареи, вызванной энтеротоксигенными штаммами кишечной палочки и ротавирусом, улучшают исходы ВИЧ-асоциированного поражения дигестивной системы, а также – усиливают иммунизирующий эффект вакцины против брюшного тифа.
Результаты недавнего систематического обзора контролируемых клинических исследований, проведенного Menchetti L. с соавт., указывают на способность трансфер фактора на основе иммунного экстракта молозива снижать риск инфекций желудочно-кишечного тракта у ослабленных детей с незрелой иммунной системой [23].
He F. с соавт. показали, что адъювантная иммунотерапии иммунным экстрактом коровьего молозива приводит к повышению концентрации специфических секреторных иммуноглобулинов класса А в слюне у пациентов, иммунизированных оральной вакциной против брюшного тифа [14].
В соответствии с этим, Huppertz H.I. с соавт. в двойном слепом плацебо контролируемом клиническом исследовании показали, что иммунный экстракт коровьего молозива приводит к уменьшению симптомов уже начавшейся диареи, вызванной энтеротоксигенными штаммами кишечной палочки, предотвращает развитие эксикоза и уменьшает потребность в инфузионной терапии [15].
Результаты нескольких контролируемых клинических исследований указывают на способность гипериммунных экстрактов коровьего молозива уменьшать симптомы диареи у детей, вызванной различными штаммами ротавируса, улучшая исходы болезни и уменьшая длительной пребывания пациента в медицинском стационаре [9, 25, 34].
Кроме этого, результаты нескольких рандомизированных контролируемых клинических исследований указывают на способность иммунного экстракта молозива уменьшать проявления персистирующей ВИЧ-ассоциированной диареи, способствуя нормализации стула, набору массы тела у истощенных пациентов и уменьшению выраженности ощущения слабости и утомляемости, улучшая качество жизни пациента [11, 18].
Коррекция микробиоценоза у недоношенных детей. Иммунные белки, содержащиеся в экстракте молозива, проявляют определенный пробиотический эффект, способствуя заселению слизистых оболочек ротовой полости и кишечника микроорганизмами, принадлежащими к нормальной микрофлоре организма человека.
Sohn K. с соавт. в небольшом рандомизированном клиническом исследовании установили, что местное назначение иммунного экстракта молозива способствует колонизации слизистой оболочки ротовой полости нормальной микрофолорой с сохранением эффекта на 48 часов после введения у недоношенных младенцев с признаками орального дисбиоза [37].
Zhang Y. с соавт. в рандомизированном контролируемом клиническом исследовании с участием 64 недоношенных новорожденных с очень малой массой тела продемонстрировали, что местное орофарингеальное применение иммунного экстракта молозива в дозе 0,2 мл каждые 4 часа на протяжении 7 последовательных суток способствует возрастанию и нормализации уровня лактоферрина в слюне и оптимизации микробиоценоза слизистой оболочки ротовой полости [39].
В другом рандомизированном контролируемом клиническом исследовании Glass K.M. с соавт. установили, что локальное применение иммунного экстракта молозива в орофарингеальной зоне обеспечивает возрастание концентрации секреторного IgA в слюне, повышение иммунорезистентности и нормализацию микробиоценоза слизистой оболочки ротовой полости у недоношенных младенцев с малой массой тела и незрелой иммунной системой (рис. 2) [11].
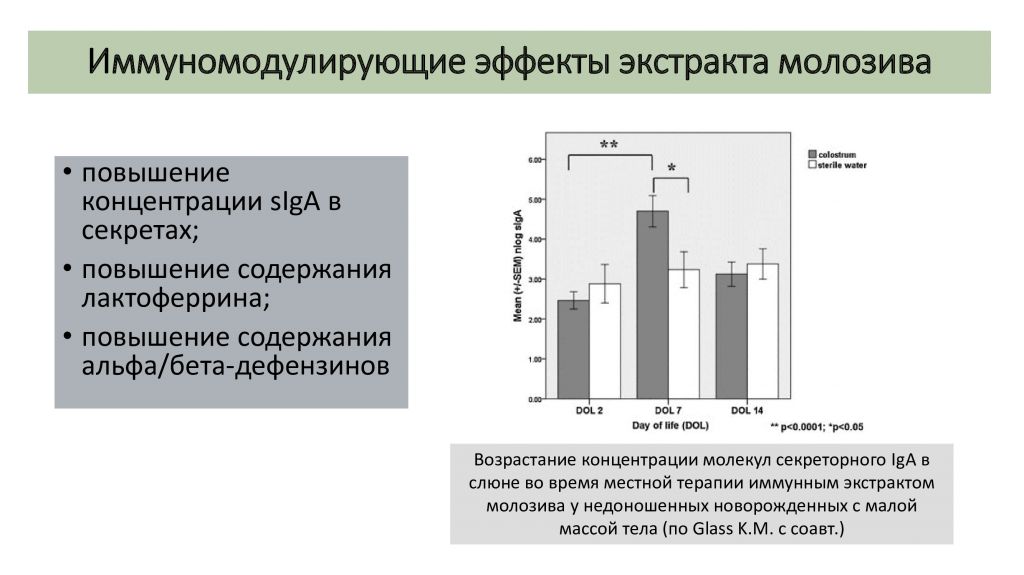
Рис. 2. Возрастание концентрации молекул секреторного IgA в слюне во время местной терапии иммунным экстрактом молозива у недоношенных новорожденных с малой массой тела (по Glass K.M. с соавт.) [11]
Romano-Keeler J. с соавт. в проспективном рандомизированном контролируемом клиническом исследовании с участием 48 недоношенных младенцев с малой массой тела выявили, что пероральная терапия трансфер фактором на основе иммунного экстракта молозива повышает содержание в слюне альфа-дефензинов, оптимизирует микробиоценоз слизистой оболочки ротовой полости, снижает восприимчивость к стрептококковой инфекции и уменьшает сроки госпитализации в среднем на 14 суток (рис. 3) [31].
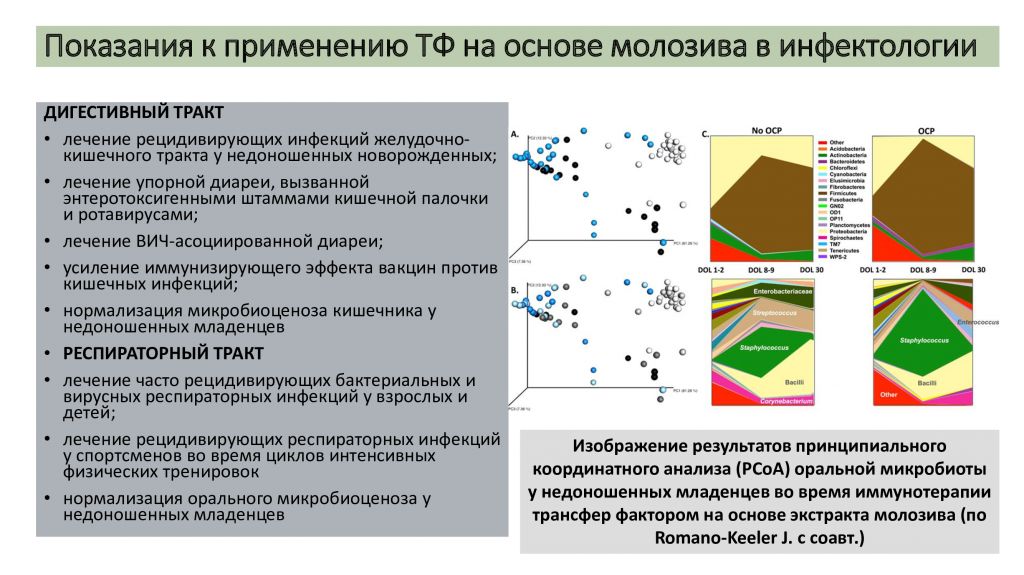
Рис. 3. Изображение результатов принципиального координатного анализа (PCoA) оральной микробиоты у недоношенных младенцев во время иммунотерапии трансфер фактором на основе экстракта молозива (по Romano-Keeler J. с соавт.) [31]
Juhl S.M. с соавт. в пилотном рандомизированном контролируемом клиническом исследовании с участием 40 недоношенных младенцев с малой массой тела и нарушенной работой дигестивного тракта показали, что раннее назначение иммунного экстракта молозива способствует быстрому восстановлению функции пищеварения, улучшению всасывания белка, приросту массы тела и нормализации микробиоценоза кишечника [17].
Лечение иммунодефицитов. Romano-Keeler J. с соавт. в рандомизированном контролируемом клиническом исследовании с участием 48 недоношенных новорожденных с вторичным иммунодефицитом показали способность трансфер фактора на основе иммунного экстракта молозива сокращать срок госпитализации пациентов в стационаре и способствовать ускоренной их реабилитации за счет компенсации иммунной дисфункции [31].
Lee J. с соавт. в двойном слепом плацебо контролируемом рандомизированном клиническом исследовании продемонстрировали, что иммунный экстракт молозива уменьшает количество эпизодов сепсиса у недоношенных младенцев с малой массой тела и признаками незрелости иммунной системы. Также показано, что иммунотерапия привела к повышению концентрации секреторного иммуноглобулина класса А и лактоферрина в биологических средах, что указывало про усиление иммунорезистентности за счет оптимизации работы местного мукозального иммунитета. Параллельно после курса иммунотерапии отмечалось снижение содержания трансформирующего фактора роста бета, интерлейкина 1бета и интерлейкина 6 в моче и слюне (рис. 4 и 5), что указывало на реализацию противовоспалительного эффекта [21].
Panahi Y. с соавт. в рандомизированном клиническом исследовании с участием 120 пациентов выявили, что пероральная иммунотерапия экстрактом коровьего молозива в дозе 40 мг/кг в сутки на протяжении 3 последовательных месяцев приводит к существенному набору массы тела у детей с неорганическим дефицитом массы тела (nonorganic failure to thrive) за счет оптимизации процессов пищеварения и улучшения работы мукозального иммунитета [28].
Byakwaga H. с соавт. в плацебо контролируемом рандомизированном клиническом исследовании с участием 75 пациентов показали, что иммунный экстракт коровьего молозива приводит к повышению количества СD4+ Т-хелперов в крови у пациентов со СПИДом ВИЧ-этиологии, плохо реагирующих на ранее проводимую высокоактивную антиретровирусную терапию согласно с протоколом [5].
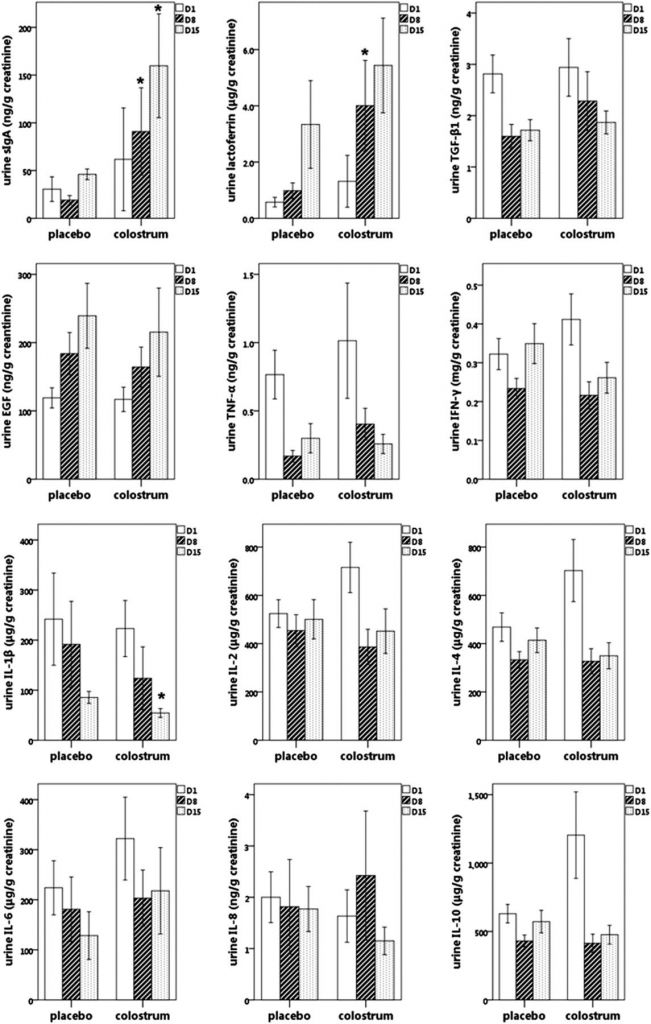
Рис. 4. Изменение концентрации секреторного иммуноглобулина А, TGF, ИЛ-1бета, ИЛ-6 в моче у недоношенных новорожденных при иммунотерапии трансфер фактором (по Lee J. с соавт.) [21]

Рис. 5. Изменение концентрации секреторного иммуноглобулина А, TGF, ИЛ-1бета, ИЛ-6 в слюне у недоношенных новорожденных при иммунотерапии трансфер фактором (по Lee J. с соавт.) [21]
Patıroğlu T., Kondolot M. в двойном слепом плацебо контролируемом клиническом исследовании с участием 31 пациента выявили, что пероральная иммунотерапия при помощи иммунного экстракта молозива приводит к резкому снижению частоты и тяжести инфекций верхних дыхательных путей у пациентов с первичным избирательным дефицитом IgA без изменения содержания секреторного IgA в слюне [29].
В соответствии с этим, Mero A. с соавт. в двойном слепом плацебо контролируемом рандомизированном клиническом исследовании установили, что долгосрочная иммунотерапия иммунным экстрактом молозива в дозе 20 мг в сутки обеспечила повышение концентрации секреторного иммуноглобулина А и трансформирующего фактора роста бета в слюне, причем этот эффект был осуществлен за счет стимуляции синтеза собственных молекул, а не посредством известного иммунозаместительного воздействия трансфер фактора [24].
Результаты контролируемого клинического исследования продемонстрировали способность трансфер фактора, содержащего иммунный экстракт молозива и экстракт иммунных белков желтков куриных яиц, повышать количество естественных киллеров и естественных киллерных Т-лимфоцитов в крови у пациентов с избирательным дефицитом этих клеток, обусловленным мутациями в генах цикла фолиевой кислоты [1].
Инфекции верхних дыхательных путей. Данные контролируемых клинических исследований указывают на способность иммунного экстракта молозива уменьшать тяжесть и сокращать частоту вирусных и бактериальных респираторных инфекций у часто и длительно болеющих взрослых и детей, а также – у спортсменов во время циклов интенсивных физических тренировок. Частично этот феномен объясняется возрастанием концентрации в секретах респираторного тракта молекул sIgA.
Так, Saad K. с соавт. в контролируемом клиническом исследовании продемонстрировали, что 4-недельный курс иммунотерапии трансфер фактором на основе экстракта молозива сокращает количество эпизодов и сроки госпитализации у детей с рецидивирующими инфекциями верхних дыхательных путей и желудочно-кишечного тракта, вызванными условно патогенными микроорганизмами [32].
В соответствии с этим, Brinkworth G.D., Buckley J.D. в двойном слепом плацебо контролируемом рандомизированном клиническом исследовании с участием 174 пациентов продемонстрировали уменьшение количества эпизодов инфекций верхних дыхательных путей без изменения их длительности у взрослых мужчин вследствие применения иммунного экстракта коровьего молозива в дозе 60 г в сутки на протяжении 8 последовательных недель [4].
Crooks C.V. с соавт. добились увеличения на 79% концентрации секреторного иммуноглобулина А в слюне у бегунов на длительные дистанции за счет применения перорально иммунного экстракта коровьего молозива, что способствовало сокращению количества эпизодов инфекций верхних дыхательных путей в период интенсивных физических тренировок и спортивных состязаний [6].
Результаты рандомизированного контролируемого клинического исследования Bardellini E. с соавт. с участием 64 пациентов указывают на пользу от добавления трансфер фактора на основе иммунного экстракта молозива к стандартной терапии при мукозите слизистой оболочки ротовой полости у детей, получающих цитостатическую химиотерапию [2].
Иммунозависимые осложнения. Иммуномодулирующие эффекты трансфер фактора на основе иммунного экстракта молозива могут быть полезны в лечении некоторых иммунозависимых болезней.
Guaragna M.A. с соавт. в контролируемом клиническом исследовании показали, что применение иммунного экстракта молозива перорально в дозе 300 мг 4 раза в сутки способствует нормализации уровня глюкозы и уменьшению суточной дозы инсулина у пациентов с резистентным сахарным диабетом 2 типа. Клинический эффект иммунотерапевтического агента связали с возрастанием сывороточной концентрации трансформирующего фактора роста бета [12].
Khan Z. с соавт. в небольшом клиническом исследовании продемонстрировали пользу от добавления иммунного экстракта молозива к стандартной противовоспалительной терапии сульфасалазином у пациентов с дистальным колитом легкой или средней степени тяжести, состоящую в нормализации стула и улучшении качества жизни пациентов [19].
Профилактическое применение
Накопленные на данный момент данные свидетельствуют, что иммунный экстракт молозива может обеспечивать профилактику диареи, вызванной энторотоксигенными штаммами кишечной палочки, снижать риск развития синдрома повышенной проницаемости кишечной стенки и связанной с этим эндотоксемии у спортсменов во время тяжелых тренировочных нагрузок и пациентов после абдоминальных хирургических вмешательств, а также – способствовать повышению результативности физических тренировок за счет более быстрого нарастания мышечной массы, сохранения оптимального эндокринного фона, улучшения когнитивных функций и оптимизации состояния вегетативной нервной системы.
Так, Otto W. с соавт. в двойном слепом плацебо контролируемом клиническом исследовании с участием 90 взрослых здоровых добровольцев установили, что профилактическое применение гипериммунного экстракта коровьего молозива обеспечивает профилактику развития диареи при инфицировании энтеротоксигенными штаммами кишечной палочки [27].
В соответствии с этим, Savarino S.J. с соавт. в недавнем двойном слепом плацебо контролируемом рандомизированном клиническом исследовании с участием 42 пациентов показали, что 7-дневный курс местной орофарингеальной терапии продуктом, содержащим иммунный экстракт молозива, осуществляет профилактический эффект по отношению к заражению энтеротоксигенными штаммами кишечной палочки за счет индукции возрастания сывороточной концентрации протективных антител против фимбрий и адгезионных молекул указанных бактерий [35].
Kotsis Y. с соавт. в двойном слепом плацебо контролируемом рандомизированном клиническом исследовании установили, что низкодозовая пероральная иммунотерапия иммунным экстрактом молозива приводит к профилактике развития признаков системного воспаления, что проявляется уменьшением концентрации С-реактивного белка и провоспалительного цитокина интерлейкина 6, и улучшению показателей Loughborough Intermittent Shuttle Test у футболистов во время цикла интенсивных тренировок (рис. 6) [20].
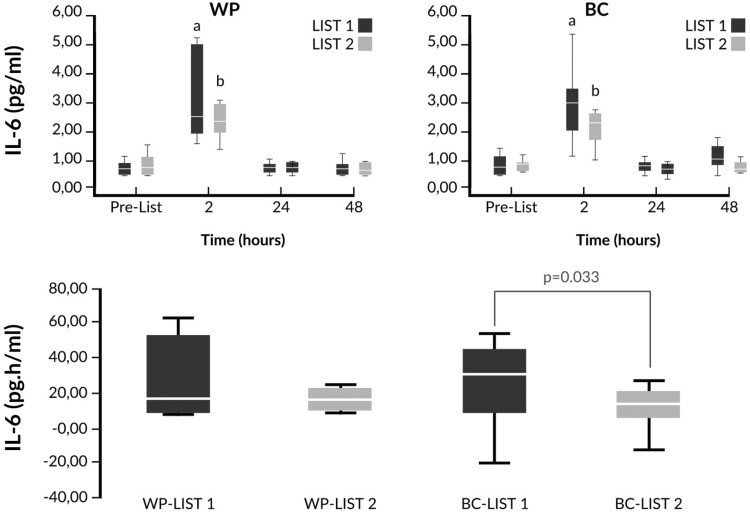
Рис. 6. Снижение сывороточной концентрации интерлейкина 6 у футболистов во время тяжелых тренировок под влиянием профилактической терапии иммунным экстрактом молозива (Kotsis Y. с соавт.) [20]
Halasa M c соавт. [13] и Marchbank T. с соавт. [22] независимо друг от друга в двойных слепых плацебо контролируемых рандомизированных клинических исследованиях получили сходные результаты, согласно которым пероральная иммунотерапия экстрактом коровьего молозива предотвращает развитие синдрома повышенной проницаемости стенки кишечника у атлетов во время тяжелых физических нагрузок в интенсивном тренировочном цикле перед спортивными состязаниями (рис. 7).
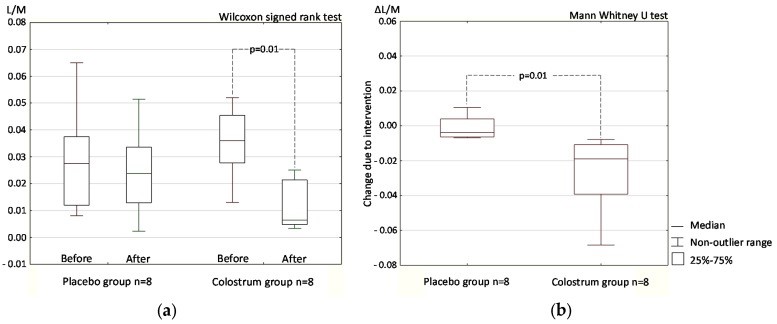
Рис. 7. Снижение проницаемости кишечной стенки у атлетов во время интенсивных тренировок под влиянием трансфер фактора на основе экстракта молозива, продемонстрированное по изменению индекса лактулоза/маннитол (по Halasa M c соавт.) [13]
В соответствии с этим, Bölke E. с соавт. в пилотном плацебо контролируемом клиническом исследовании с участием 40 пациентов установили, что периоперативная иммунотерапия иммунным экстрактом молозива способствует уменьшению эндотоксемии, сохранению эндотоксин-связывающей способности крови и предотвращает развитие синдрома повышенной проницаемости кишечной стенки у лиц, которым проводятся абдоминальные хирургические операции [3].
Duff W.R. с соавт. в двойном слепом плацебо контролируемом рандомизированном клиническом исследовании установили, что добавление иммунного экстракта молозива в дозе 60 г/сутки к пищевому рациону способствует нарастанию мышечной массы и силы, а также улучшению когнитивных функций у лиц пожилого возраста, которые проходят интенсивные физические тренировки [8].
Shing C.M. с соавт. в небольшом рандомизированном контролируемом клиническом исследовании выявили, что добавление к пищевому рациону иммунного экстракта молозива обеспечивает сохранение нормального уровня тестостерона и поддержание оптимальной функции парасимпатической вегетативной нервной системы у спортсменов во время цикла интенсивных физических тренировок [36].
Jones A.W. с соавт. в двойном слепом плацебо контролируемом рандомизированном клиническом исследовании с участием 31 мужчины-спортсмена показали, что 58-суточный курс иммунного экстракта молозива сохраняет иммунореактивность кожи в ответ на введение DPCP во время пролонгированного цикла тренировочных физических нагрузок в отличие от участников, получающих плацебо, у которых отмечались признаки снижения иммунореактивности и появлялись проявления вторичной иммуносупресии (рис. 8) [16].
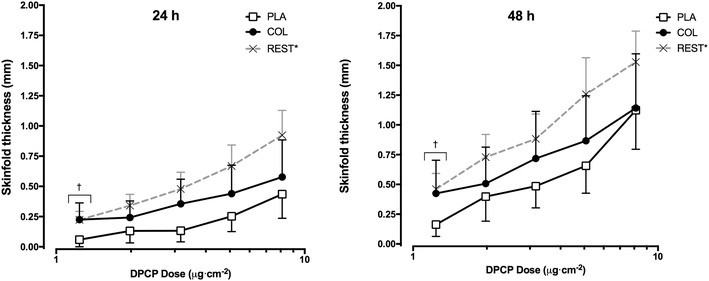
Рис. 8. Сохранение иммунореактивного ответа через 24 и 48 часов после локального введения DPCP у спортсменов во время пролонгированного курса физических нагрузок на фоне приема иммунного экстракта молозива (по Jones A.W. с соавт.) [16]
Выводы. Продукты на основе иммунного экстракта молозива обладают клинически значимыми иммунозаместительными и иммуномодулирующими эффектами с преимущественным воздействием на гуморальное звено врожденного и адаптивного иммунитета. Такие трансфер факторы компенсируют нарушения местного мукозального иммунитета слизистых оболочек ротовой полости и желудочно-кишечного тракта, усиливая тем самым их антимикробную резистентность, а также – оказывают локальное и системное противовоспалительное воздействие, снижают риск развития синдрома повышенной проницаемости кишечной стенки, улучшают процессы пищеварения и нормализуют состояние орального и кишечного микробиоценоза. Согласно накопленной доказательной базе иммунный экстракт молозива является высокоактивным иммунобиологическим агентом с полимодальными терапевтическими эффектами, который является полезным при лечении и профилактике бактериальных и вирусных инфекций верхних дыхательных путей и дигестивной системы у взрослых и детей, персистирующего дисбиоза слизистых оболочек ротовой полости и кишечника, некоторых первичных и вторичных иммунодефицитных заболеваний человека. Эти иммуномодулирующие продукты повышают эффективность и безопасность для здоровья тяжелых физических нагрузок в интенсивных тренировочных циклах у спортсменов, занимающихся различными видами спорта. Доказательства, полученные в ходе рандомизированных контролируемых клинических исследований, должны способствовать широкому применению трансфер факторов на основе иммунного экстракта молозива в современной клинической практике по известным показаниям. Без сомнения, следует проводить дальнейшие рационально спланированные испытания эффективности и безопасности этих многообещающих иммунобиологических агентов для укрепления и расширения текущей доказательной базы их клинического применения.
Список литературы
1. Мальцев Д.В. Эффективность трансфер фактора при лечении дефицита NK- и/или NKT-клеток, ассоциированного с генетическим дефицитом фолатного цикла // Імунологія та алергологія. Додаток, – 2019. – №1. – С. 66–67.
2. Bardellini E., Amadori F., Majorana A. Oral hygiene grade and quality of life in children with chemotherapy-related oral mucositis: a randomized study on the impact of a fluoride toothpaste with salivary enzymes, essential oils, proteins and colostrum extract versus a fluoride toothpaste without menthol // Int. J. Dent. Hyg. – 2016. – Vol. 14(4). – P. 314–319.
3. Bölke E., Jehle P.M. Hausmann F. et al. Preoperative oral application of immunoglobulin-enriched colostrum milk and mediator response during abdominal surgery // Shock. – 2002. – Vol. 17(1). – P. 9–12.
4. Brinkworth G.D., Buckley J.D. Concentrated bovine colostrum protein supplementation reduces the incidence of self-reported symptoms of upper respiratory tract infection in adult males // Eur. J. Nutr. – 2003. – Vol. 42(4). – P. 228–232.
5. Byakwaga H., Kelly M., Purcell D.F. et al. Intensification of antiretroviral therapy with raltegravir or addition of hyperimmune bovine colostrum in HIV-infected patients with suboptimal CD4+ T-cell response: a randomized controlled trial // J. Infect. Dis. – 2011. – Vol. 204(10). – P. 532–540.
6. Crooks C.V., Wall C.R., Cross M.L. et al. Rutherfurd-Markwick K.J. The effect of bovine colostrum supplementation on salivary IgA in distance runners // Int. J. Sport Nutr. Exerc. Metab. – 2006. – Vol. 16(1). – P. 47–64.
7. Deubzer H.E., Obaro S.K., Newman V.O. et al. Colostrum obtained from women vaccinated with pneumococcal vaccine during pregnancy inhibits epithelial adhesion of Streptococcus pneumonia // J. Infect. Dis. – 2004. – Vol. 90(10). – P. 1758–61.
8. Duff W.R., Chilibeck P.D., Rooke J.J. et al. The effect of bovine colostrum supplementation in older adults during resistance training // Int. J. Sport Nutr. Exerc. Metab. – 2014. – Vol. 24(3). – P. 276–285.
9. Ebina T., Sato A., Umezu K. et al. Prevention of rotavirus infection by cow colostrum antibody against human rotaviruses // Lancet. – 1983. – Vol. 2(8357). – P. 1029–1030.
10. Florén C.H., Chinenye S., Elfstrand L. et al. ColoPlus a new product based on bovine colostrum, alleviates HIV-associated diarrhea // Scand. J. Gastroenterol. – 2006. – Vol. 41(6). – P. 682–686.
11. Glass K.M., Greecher C.P., Doheny K.K. Oropharyngeal Administration of Colostrum Increases Salivary Secretory IgA Levels in Very Low-Birth-Weight Infants // Am. J. Perinatol. – 2017. – Vol. 14. – P. 1389–1395.
12. Guaragna M.A., Albanesi M., Stefani S. et al. The effectiveness of oral goat colostrum in the treatment of patients with type 2 diabetes mellitus: our preliminary experience // Clin. Ter. – 2013. – Vol. 164(2). – P. 111–114.
13. Hałasa M., Maciejewska D,, Baśkiewicz-Hałasa M. et al. Oral Supplementation with Bovine Colostrum Decreases Intestinal Permeability and Stool Concentrations of Zonulin in Athletes // Nutrients. – 2017. – Vol. 9(4). – E.370.
14. He F., Tuomola E., Arvilommi H., Salminen S. Modulation of human humoral immune response through orally administered bovine colostrum. // FEMS Immunol. Med. Microbiol. – 2001. – Vol. 31(2). – P. 93–96.
15. Huppertz H.I., Rutkowski S., Busch D.H. et al. Bovine colostrum ameliorates diarrhea in infection with diarrheagenic Escherichia coli, shiga toxin-producing E. Coli, and E. coli expressing intimin and hemolysin // J. Pediatr. Gastroenterol. Nutr. – 1999. – Vol. 29(4). – P. 452–456.
16. Jones A.W., March D.S., Thatcher R. et al. The effects of bovine colostrum supplementation on in vivo immunity following prolonged exercise: a randomised controlled trial // Eur. J. Nutr. – 2019. – Vol. 58(1). – P. 335–344.
17. Juhl S.M., Ye X., Zhou P., Li Y. et al. Bovine Colostrum for Preterm Infants in the First Days of Life: A Randomized Controlled Pilot Trial // J. Pediatr. Gastroenterol. Nutr. – 2018. – Vol. 66(3). – P. 471–478.
18. Kaducu F.O., Okia S.A., Upenytho G. et al. Effect of bovine colostrum-based food supplement in the treatment of HIV-associated diarrhea in Northern Uganda: a randomized controlled trial // Indian J. Gastroenterol. – 2011. – Vol. 30(6). – P. 270–276.
19. Khan Z., Macdonald C., Wicks A.C. et al. Use of the 'nutriceutical', bovine colostrum, for the treatment of distal colitis: results from an initial study // Aliment. Pharmacol. Ther. – 2002. – Vol. 16(11). – P. 1917–1922.
20. Kotsis Y., Mikellidi A., Aresti C. et al. A low-dose, 6-week bovine colostrum supplementation maintains performance and attenuates inflammatory indices following a Loughborough Intermittent Shuttle Test in soccer players // Eur. J. Nutr. – 2018. – Vol. 57(3). – P. 1181–1195.
21. Lee J., Kim H.S., Jung Y.H. Oropharyngeal colostrum administration in extremely premature infants: an RCT // Pediatrics. – 2015. – Vol. 135(2). – P. 357–366.
22. Marchbank T., Davison G., Oakes J.R. et al. The nutriceutical bovine colostrum truncates the increase in gut permeability caused by heavy exercise in athletes // Am J. Physiol. Gastrointest. Liver Physiol. – 2011. – Vol. 300(3). – G. 477–484.
23. Menchetti L., Traina G., Tomasello G. et al. Potential benefits of colostrum in gastrointestinal diseases // Front Biosci (Schol Ed). – 2016. – Vol. 1(8). – P. 331–351.
24. Mero A., Kähkönen J., Nykänen T. et al. IGF-I, IgA, and IgG responses to bovine colostrum supplementation during training // J. Appl. Physiol. – 2002. – Vol. 93(2). – P. 732–739.
25. Mitra A.K., Mahalanabis D., Ashraf H. Hyperimmune cow colostrum reduces diarrhoea due to rotavirus: a double-blind, controlled clinical trial // Acta Paediatr. – 1995. – Vol. 84(9). – P. 996–1001.
26. Ojofeitimi E.O. Elegbe I.A. The effect of early initiation of colostrum feeding on proliferation of intestinal bacteria in neonates // Clin. Pediatr. (Phila). – 1982. – Vol. 21(1). – P. 39–42.
27. Otto W., Najnigier B., Stelmasiak T., Robins-Browne R.M. Randomized control trials using a tablet formulation of hyperimmune bovine colostrum to prevent diarrhea caused by enterotoxigenic Escherichia coli in volunteers // Scand. J. Gastroenterol. – 2011. – Vol. 46(7-8). – P. 862–868.
28. Panahi Y., Falahi G., Falahpour M. et al. Bovine colostrum in the management of nonorganic failure to thrive: a randomized clinical trial // J. Pediatr. Gastroenterol. Nutr. – 2010. – Vol. 50(5). – P. 551–554.
29. Patıroğlu T., Kondolot M. The effect of bovine colostrum on viral upper respiratory tract infections in children with immunoglobulin A deficiency // Clin. Respir. J. – 2013. – Vol. 7(1). – P. 21–26.
30. Rathe M., Müller K., Sangild P.T., Husby S. Clinical applications of bovine colostrum therapy: a systematic review // Nutr. Rev. – 2014. – Vol. 72(4). – P. 237–254.
31. Romano-Keeler J., Azcarate-Peril M.A., Weitkamp J.H. et al. Oral colostrum priming shortens hospitalization without changing the immunomicrobial milieu // J. Perinatol. – 2017. – Vol. 37(1). – P. 36–41.
32. Saad K., Abo-Elela M.G., El-Baseer K.A. et al. Effects of bovine colostrum on recurrent respiratory tract infections and diarrhea in children // Medicine (Baltimore). – 2016. – Vol. 95(37). – E 4560.
33. Sacerdote P., Mussano F., Franchi S. et al. Biological components in a standardized derivative of bovine colostrums // J. Dairy Sci. – 2013. – Vol. 96. – P. 1745–1754.
34. Sarker S.A., Casswall T.H., Mahalanabis D. et al. Successful treatment of rotavirus diarrhea in children with immunoglobulin from immunized bovine colostrum // Pediatr. Infect. Dis. J. – 1998. – Vol. 17(12). – P. 1149–1154.
35. Savarino S.J., McKenzie R., Tribble D.R. et al. Prophylactic Efficacy of Hyperimmune Bovine Colostral Antiadhesin Antibodies Against Enterotoxigenic Escherichia coli Diarrhea: A Randomized, Double-Blind, Placebo-Controlled, Phase 1 Trial // J. Infect. Dis. – 2017. – Vol. 216(1). – P. 7–13.
36. Shing C.M., Peake J.M., Suzuki K. et al. A pilot study: bovine colostrum supplementation and hormonal and autonomic responses to competitive cycling // J. Sports Med. Phys. Fitness. – 2013. – Vol. 53(5). – P. 490–501.
37. Sohn K., Kalanetra K.M., Mills D.A., Underwood M.A. Buccal administration of human colostrum: impact on the oral microbiota of premature infants // J. Perinatol. – 2016. – Vol. 36(2). – P. 106–111.
38. Zhang L., Boeren S.,. Hageman J.A. et al. Bovine Milk Proteome in the First 9 Days: Protein Interactions in Maturation of the Immune and Digestive System of the Newborn // PLoS One. – 2015. – journal.pone. 0116710.
39. Zhang Y., Ji F., Hu X., Cao Y. et al. Oropharyngeal Colostrum Administration in Very Low Birth Weight Infants: A Randomized Controlled Trial // Pediatr. Crit. Care Med. – 2017. – Vol. 18(9). – P. 869–875.
РЕЗЮМЕ
УДК 615.37
Клиническое применение трансфер факторов на основе экстракта молозива
Мальцев Д.В.
Институт экспериментальной и клинической медицины НМУ имени А.А. Богомольца
Общим термином «трансфер факторы» обозначают группу гетерогенных по составу иммунобиологических агентов, содержащих экстракт иммунных белков той или иной биологической среды организма донора.
На данный момент разработано и внедрено в клиническую практику три вида препаратов трансфер факторов по происхождению – на основе диализата суспензии лейкоцитов крови, иммунного экстракта белков куриных яиц и иммунного экстракта белков молозива. Имеются также комбинированные продукты, например, сочетающие в своем составе экстракты молозива и желтков куриных яиц.
Согласно накопленной доказательной базе иммунный экстракт молозива является высокоактивным иммунобиологическим агентом с полимодальными терапевтическими эффектами, который является полезным при лечении рецидивирующих бактериальных и вирусных инфекций верхних дыхательных путей и дигестивной системы у взрослых и детей, персистирующем дисбиозе ротовой полости и кишечника, некоторых первичных и вторичных иммунодефицитных заболеваниях человека. Эти иммуномодулирующие продукты повышают эффективность и безопасность для здоровья тяжелых физических нагрузок в интенсивных тренировочных циклах у спортсменов. Доказательства, полученные в ходе рандомизированных контролируемых клинических исследований, должны способствовать широкому применению трансфер факторов на основе иммунного экстракта молозива в современной клинической практике по известным показаниям. Без сомнения, следует проводить дальнейшие рационально спланированные испытания эффективности и безопасности этих многообещающих иммунобиологических агентов для укрепления и расширения текущей доказательной базы клинического применения.
Ключевые слова: трансфер фактор, иммуномодуляция, экстракт молозива.
УДК 615.37
РЕЗЮМЕ
Клінічне застосування трансфер факторів на основі екстракту молозива
Мальцев Д.В.
Інститут експериментальної і клінічної медицини НМУ імені О.О. Богомольця
Загальним терміном «трансфер фактори» позначають групу гетерогенних за складом імунобіологічних агентів, що містять екстракт імунних білків того чи іншого біологічного середовища організму донора.
На даний момент розроблено та впроваджено в клінічну практику три види препаратів трансфер факторів за походженням – на основі діалізата суспензії лейкоцитів крові, імунного екстракту білків курячих яєць і імунного екстракту білків молозива. Є також комбіновані продукти, наприклад такі, що поєднують у своєму складі екстракти імунних білків молозива і жовтків курячих яєць.
Згідно з накопиченою дотепер доказовою базою імунний екстракт молозива є високоактивним імунобіологічних агентом з полімодальними терапевтичними ефектами, який є корисним при лікуванні рецидивуючих бактеріальних і вірусних інфекцій верхніх дихальних шляхів і дигестивної системи у дорослих і дітей, персистуючому дизбіозі слизових оболонок ротової порожнини і кишечника, деяких первинних і вторинних імунодефіцитних захворюваннях людини. Ці імуномодулюючі продукти підвищують ефективність і безпечність для здоров'я важких фізичних навантажень в інтенсивних тренувальних циклах у спортсменів. Докази, отримані в ході рандомізованих контрольованих клінічних досліджень, повинні сприяти широкому застосуванню трансфер факторів на основі імунного екстракту молозива в сучасній клінічній практиці за відомими показаннями. Без сумніву, слід проводити подальші раціонально сплановані випробування ефективності та безпечності цих багатообіцяючих імунобіологічних агентів для зміцнення і розширення поточної доказової бази їх клінічного застосування.
Ключові слова: трансфер фактор, імуномодуляція, екстракт молозива.
UDC 615.37
SUMMARY
Clinical application of transfer factors based on colostrum extract
Maltsev D.V.
Institute of Experimental and Clinical Medicine at the O’Bogomolets NMU
The general term "transfer factors" refers to a group of heterogeneous immunobiological agents containing an extract of immune proteins of a particular biological environment of the donor organism.
Currently, three types of origin transfer drugs have been developed and implemented in clinical practice – based on dialysis of blood leukocyte suspension, immune protein extract of chicken eggs and immune colostrum protein extract. There are also combined products, such as combining extracts of immune proteins of colostrum and yolks of chicken eggs.
Products based on immune colostrum extract have clinically significant immunosubstitutional and immunomodulatory effects with a predominant effect on the humoral branch of innate and adaptive immunity. In particular, these agents are capable of inducing the synthesis of such molecules as secretory immunoglobulin class A and lactoferrin, alpha-defensins antimicrobial proteins.
According to the accumulated evidence base immune colostrum extract is a highly active immunobiological agent with multimodal therapeutic effects, which is useful in the treatment and prophylactic of recurrent bacterial and viral infections of the upper respiratory tract and digestive system in adults and children, primary and secondary human immunodeficiency diseases. These immunomodulatory products increase the efficiency and safety of heavy physical activity in intense training cycles in athletes. Evidence from randomized controlled clinical trials should facilitate the widespread use of transfer factor based on colostrum immune extract in current clinical practice, according to known indications.
Undoubtedly, further rationally planned trials of the efficacy and safety of these promising immunobiological agents should be conducted to strengthen and expand the current evidence base for their clinical application.
Keywords: transfer factor, immunomodulation, colostrum extract.